§6. Химические формулы. Относительная атомная и молекулярная массы
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1. https://himi4ka.ru/arhiv−urokov/urok−2−otnositelnaja−atomnaja−massa−himicheskih−jelementov.html
2. https://himi4ka.ru/arhiv−urokov/urok−5−himicheskaja−formula.html
3. https://himi4ka.ru/arhiv−urokov/urok−7−otnositelnaja−molekuljarnaja−i−otnositelnaja−formulnaja−massy.html
4. https://ru.wikipedia.org/wiki/Химическая_формула
5. https://foxford.ru/wiki/himiya/massovaya−dolya−elementa−massovaya−dolya−veschestva
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Относительная атомная масса (Ar)
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Значительно позже работ Берцелиуса массы атомов химических элементов стали сравнивать с 1/12 массы атома углерода Относительная атомная масса химического элемента показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Относительная атомная масс обозначается Аr, она не имеет единиц измерения, так как показывает отношение масс атомов.
Абсолютная масса 1/12 атома углерода является эталонной единицей, значение которой вычислено с высокой точностью и составляет 1,66 *10-24 г или 1,66 *10-27 кг. Эта эталонная масса называется атомной единицей массы (а.е.м.).
При расчетах значения относительных атомных масс принято округлять до целых. Исключение составляет относительная атомная масса хлора – для хлора используют значение 35,5
?. Вопросы и задания
1. Что означают записи: 3H; 2H2O; 5O2?
Ответ:
3H – 3 атома водорода;
2H2O – 2 молекулы воды, состоящих из 1 атома кислорода и 2 атомов водорода каждая;
5O2 – 5 молекул кислорода, состоящих из 2 атомов кислорода каждая.
2. Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
Ответ:
Сахароза − C12H22O11.
3. Используя рисунок 2 (см. с. 5), запишите формулы веществ и рассчитайте их относительные молекулярные массы.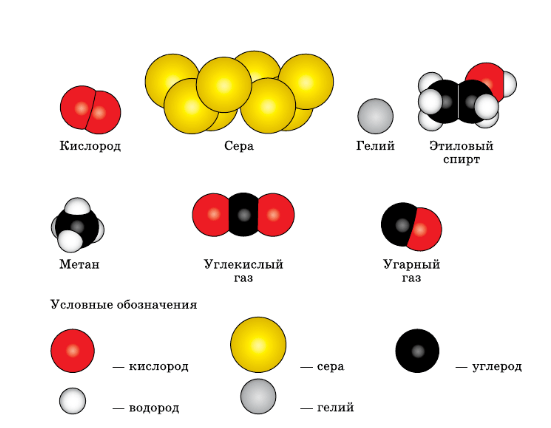
рис. 2. Модели молекул некоторых веществ.
Ответ:
Кислород − O2.
Ar (O) = 16
Mr (O2) = 2 * Ar(O)= 2 * 16 = 32
Сера − S8
Ar (S)= 32
Mr (S8) = 8 * Ar(S) = 8 * 32= 256
Гелий − Не
Ar (Не) = 4
Mr (He) = 1 * Ar(He) = 1 * 4= 4
Этиловый спирт − C2H5OH
Ar (C) = 12
Ar (Н) = 1
Ar (O) = 16
Mr(C2H5OH) = 2 * Ar(C) + 6 * Ar(H) + Ar(O) = 2 * 12 + 6 * 1 + 16 = 46
Метан − CH4
Ar (C) = 12
Ar (Н) = 1
Mr(CH4) = Ar(C) + 4 * Ar(H) = 12 + 4 * 1 = 16
Углекислый газ − CO2
Ar (C) = 12
Ar (O) = 16
Mr(CO2) = Ar(C) + 2 * Ar(O) = 12 + 2 * 16 = 44
Угарный газ − CO
Ar (C) = 12
Ar (O) = 16
Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28
4. Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O2; 4CO2?
Ответ:
3O – атомарное состояние кислорода (3 атома).
5O2 – простое двухатомное вещество кислород (5 молекул).
4CO2 – 4 молекулы углекислого газа, в каждой из которых присутствуют 2 атома кислорода и 1 атом углерода, сложное трёхатомное вещество.
5. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
Ответ:
Относительная атомная масса элемента и относительная молекулярная масса вещества показывают, во сколько раз масса атома химического элемента или молекула вещества, больше, чем 1/12 массы атома углерода.
А кратность (то есть показатель "во сколько раз") не имеет единицы измерения.
6. В каком из веществ, формулы которых $SO_{2}$ и $SO_{3}$, массовая доля серы больше? Ответ подтвердите расчётами.
Ответ:
Дано:
$SO_{2}$;
$SO_{3}$
_____________
$w_{1}(S)$ − ?
$w_{2}(S)$ − ?
Решение:
$w (Э) = \frac{n * Ar (Э)}{Mr (вещ-ва)}$;
Ar (S) = 32;
Ar (O) = 16;
Mr ($SO_2$) = 1 * Ar(S) + 2 * Ar(O)= 32 + 2 * 16 = 64;
$w_{1} (S) = \frac{n * Ar (S)}{Mr(SO_{2})} = \frac{1 * 32}{64} = 0,5$ = 50 %;
Mr ($SO_3$) = 1 * Ar(S) + 3 * Ar(O)= 32 + 3 * 16 = 80;
$w_{2} (S) = \frac{n * Ar (S)}{Mr(SO_{3})} = \frac{1 * 32}{80} = 0,4$ = 40%.
$w_{1}(S) > w_{2}(S)$
Ответ: массовая доля серы в молекуле $SO_{2}$ больше, чем в молекуле $SO_{3}$.
7. Вычислите массовые доли элементов в азотной кислоте $HNO_{3}$?
Ответ:
Дано:
$HNO_{3}$.
_____________
w (Н) − ?
w (N) − ?
w (О) − ?
Решение:
$w (Э) = \frac{n * Ar (Э)}{Mr (вещ-ва)}$;
Ar (Н) = 1;
Ar (N) = 14;
Ar (O) = 16;
Mr ($HNO_{3}$) = 1 * Ar (H) + 1 * Ar (N) + 3 * Ar (O) = 1 * 1 + 1 * 14 + 3 * 16 = 63.
$w (Н) = \frac{n * Ar (H)}{Mr(HNO_{3})} = \frac{1 * 1}{63}$ * 100 % = 1,6 %.
$w (N) = \frac{n * Ar (N)}{Mr(HNO_{3})} = \frac{1 * 14}{63}$ * 100 % = 22,2 %
$w (O) = \frac{n * Ar (O)}{Mr(HNO_{3})} = \frac{3 * 16}{63}$ * 100 % = 76,2 %
Ответ: 1,6 %; 22,2 %; 76,2 %.
8. Дайте полную характеристику глюкозы $C_{6}H_{12}O_{6}$, используя пример описания углекислого газа $CO_{2}$ (см. с.42).
Ответ:
Глюкоза $C_{6}H_{12}O_{6}$.
1. Конкретное вещество: глюкоза.
2. Качественный состав: состоит из трех элементов: углерода, водорода и кислорода.
3. Тип вещества: сложное вещество.
4. Количественный состав вещества: 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
5. Относительная молекулярная масса
Mr ($C_{6}H_{12}O_{6}$) = 6 * Ar (C) + 12 * Ar (Н) + 6 * Ar (O) = 6 * 12 + 12 * 1 + 6 * 16 = 180.
6. Соотношение масс элементов: m (H) : m (C) : m (O) = 72 : 12 : 96 = 6 : 1 : 8.
7. Массовые доли элементов в этом веществе:
$w (С) = \frac{n * Ar (C)}{Mr(C_{6}H_{12}O_{6})} = \frac{6 * 12}{180}$ * 100 % = 40 %.
$w (O) = \frac{n * Ar (O)}{Mr(C_{6}H_{12}O_{6})} = \frac{12 * 1}{180}$ * 100 % = 6,7 %
$w (H) = \frac{n * Ar (H)}{Mr(C_{6}H_{12}O_{6})} = \frac{6 * 16}{180}$ * 100 % = 53,3 %
Темы для дискуссии
1. Отношение людей к достижениям химии: хемофилия и хемофобия. Какую точку зрения вы поддерживаете?
Ответ ©:
Хемофилия — «любовь к химии», хемофобия — «боязнь химии». Это две крайности отношения к химии, поэтому моя точка зрения лежит где-то посередине. С одной стороны, без химии невозможна жизнь современного человека, поскольку любое промышленное производство - это химия. Человек научился изготавливать пластмассы из нефти, извлекать металлы из руд, делать лекарства, удобрения, инсектициды. Без всего этого современная жизнь немыслима. С другой стороны, многие продукты и выбросы химической промышленности загрязняют окружающую среду, все больше химических веществ применяется в производстве продуктов питания, а это вредно для здоровья человека. Во всем нужен рациональный подход.
2. Оцените вклад российских учёных в развитие мировой химической науки. Насколько, с вашей точки зрения, значим этот вклад?
Ответ:
М.В.Ломоносов, А.М.Бутлеров, Д.И.Менделеев, С.В.Лебедев, Н.Ф.Зелинский – представить себе существование химии (а равно и всей современной промышленности) без этих имен невозможно.
При освоении атомно−молекулярного учения всегда упоминается великий вклад М.В.Ломоносова, который в 1748 году сформулировал закон сохранения массы веществ, а в 1756 году подтвердил его опытами с запаянными сосудами. Значительно позже, в 1789 году этот же закон, независимо от Ломоносова, был выведен французским химиком Лавуазье.
Именно по настоянию М.В.Ломоносова и его проекту, в 1756 году был открыт первый в России университет в Москве.
Трудно не то чтобы переоценить, а реально осмыслить роль Д.И.Менделеева в развитии химии (даже не в развитии, а гигантском скачке вперед). В 1869 году, в возрасте 35 лет, он открывает периодический закон и создает периодическую систему химических элементов. Менделеев не только распределяет химические элементы в периодической таблице, но и оставляет свободные места в периодах для еще не открытых, но уже предсказанных элементов. В течение последующих 15 лет три описанных элемента были открыты.
Французский химик Лекок де Буабодрак открыл галлий, затем в Швеции Л.Ф.Нильсон открывает скандий, в Германии К.А.Винклер открыл германий. Ни в малой степени не умаляя значений этих открытий, следует отметить, что ученые шли уже по проторенной дороге.
Последующее развитие науки позволило, опираясь на периодический закон, глубоко познать строение вещества.
Огромный вклад в развитие органической химии внес А.М.Бутлеров. Трудно себе представить, какой хаос царил в органике в начале XIX в. Ученые умели определять качественный и количественный состав веществ, но не имели представления о том, как атомы соединяются в молекулы, не пользовались привычными для нас формулами, не знали валентности, химических реакции описывали словами, а не формулами. До Бутлерова было много попыток классифицировать органические вещества:
− теория этерина французского химика Ж.Б.Дюма (1820);
− теория радикалов Ф.Велера и Ю.Либиха (1832);
− теория типов О.Лорана и Ш.Жерара (1840);
− открытие Э.Франклиндом валентности, которое было обобщено и развито немецким химиком Ф.А.Кекуле (1853).
Постепенное накопление экспериментального материала и его осмысление вылились в теорию химического строения органических веществ Бутлерова в 1861 году. Согласно этой теории, свойства соединений определяются их качественным и количественным составом, химическим строением, т.е. последовательным порядком соединения между собой образующих молекулу атомов, и их взаимным влиянием. Большое значение для становления теории химического строения имело её экспериментальное подтверждение в работах как самого Бутлерова, так и его школы. Он предвидел, а затем и доказал существование позиционной и скелетной изомерии.
Основоположником промышленного способа получения синтетического каучука, одного из важнейших разделов современной химической промышленности, явился С.В.Лебедев, русский химик, академик. Он провел цикл работ в области высоко− и низкотемпературной полимеризации изобутилена, лежащей в основе методов производства бутилкаучука (новейшая разновидность синтетического каучука), 100−октановых компонентов моторных топлив и загустителей смазочных масел.
В 1928 году С.В.Лебедев получил синтетический каучук полимеризацией 1,3−бутадиена под действием натрия.
И это далеко не полный перечень выдающихся умов России, активно способствовавших поступательному развитию мирового прогресса.
Таким образом, вклад российских учёных в развитие мировой химической науки не оценим. Именно благодаря нашим учёным, происходил рывок в развитии химической науки.
3. Насколько этимологическое значение термина «атом» соответствует современным представлениям о нём?
Ответ:
Атом − заимствовано в Петровскую эпоху из греч. яз., в котором atomos «неделимый»: из a − «не» и temnō − «делю, ломаю». Атом − частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов.
Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что реальная частица, которой было присвоено имя атома, в действительности не является неделимой.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Таким образом, этимологическое значение термина «атом» не соответствует современным представлениям о нём.

