ГЛАВА ПЯТАЯ. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции
§35. Растворение. Растворимость веществ в воде
i. Работа в информационной среде
1. Найдите в Интернете электронные адреса, раскрывающие содержание ключевых слов и словосочетаний параграфа для создания классного банка данных.
Ответ:
1.http://www.hemi.nsu.ru/ucheb176.htm
2. https://ru.wikipedia.org/wiki/Растворимость
3. https://blog.tutoronline.ru/rastvorenie−rastvorimost−vewestv−v−vode
4. https://www.yaklass.ru/p/himija/89−klass/rastvory−58606/rastvorenie−rastvorimost−88647
5. http://schooled.ru/chemistry/admission/49.html
6. https://nauka.club/khimiya/kristallogidraty.html
2. Используя ресурсы Интернета, подготовьте информационный продукт (по выбору): презентацию по теме урока или сообщение по одному из ключевых слов (словосочетаний) параграфа.
Ответ:
Гидраты и кристаллогидраты, кристаллизационная вода
Гидраты – продукты присоединения воды (гидратации) к молекулам, атомам, ионам. Они могут быть твердые, жидкие и реже газообразные. Твердые гидраты, имеют свое название – кристаллогидраты.
Кристаллогидраты – твердые вещества, продукты присоединения воды (гидратация) к атомам, молекулам или ионам.
Кристаллизационная вода – вода, входящая в состав кристаллогидратов.
Кристаллогидраты создаются, когда катионы вещества кристаллической решетки образуют связи с водными молекулами. Соединения более прочные, чем связи анионов и катионов в кристаллах безводной соли. Примечательным свойством кристаллогидратов является то, что при низких температурах содержащаяся в них жидкость связывается с катионами и ионами солей. Основания, кислоты, а также значительное количество солей из водных растворов в осадок выпадают кристаллогидратами, завершая кристаллизационный процесс.
История.
История этих химических элементов начинается с 1826 года, когда были открыты гидраты спирта.Дальнейшее продолжение их изучения связано с Д. И. Менделеевым. В процессе исследования реакции соединения воды и спирта он определил, что при этом образуются новые соединения, которые сопровождают химические и физические процессы. В 1880 году понятие гидраты было введено в химии для характеристики определённых соединений веществ, растворенных в жидкости. Однако систематическое и подробное изучение кристаллогидратов, возможность рассчитать их массовую долю, выявление и установление составляющих началось только в 1889 году.
Растворение в воде.
Растворение кристаллогидратов в воде — сложный химико−физический процесс. При этом решетка кристаллическая у соединения может рушиться, а образуемые вследствие этого элементы (частички) распространяются по всему раствору. Такое преобразование способно выдать значительную тепловую энергию.
Объём в соединениях воды может быть различным: от молей дробного числа на моль вещества до значительного молярного объема. В зависимости от состояния температуры среды одно и то же вещество может иметь в себе различное количество молекул воды. Отдельные кристаллогидраты при попадании на воздух могут терять кристаллизационную воду самостоятельно (самопроизвольно), что называется выветриванием. В большинстве случаев, чтобы удалить жидкость (воду) искусственно, привести ее к обезвоживанию, используют нагревание и прокаливание.
Области применения.
Кристаллогидраты нашли применение в различных отраслях народного хозяйства. Так, гипс используется в медицинской сфере (в стоматологии, хирургии, ортопедии).
В медицине широко применяются сульфат натрия, сульфат магния, сульфат цинка, цитрат натрия, хлорид кальция, нитрат кальция, хлористое железо. Медный купорос известен как красящее вещество для тканей. Его растворами защищают древесину, протравливают семена. Метан в природных условиях в виде кристаллогидрата залегает в недрах Земли в огромных количествах, являясь перспективным моторным топливом.
?. Вопросы и задания
1. Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
Ответ:
Растворимость веществ в воде зависит от температуры. Как правило, растворимость твёрдых веществ в воде увеличивается с повышением температуры. Чем выше температура, тем выше скорость движения молекул воды и сахара, т. е. молекулы воды чаще взаимодействуют с молекулами сахара, поэтому интенсивнее происходит растворение.
2. Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
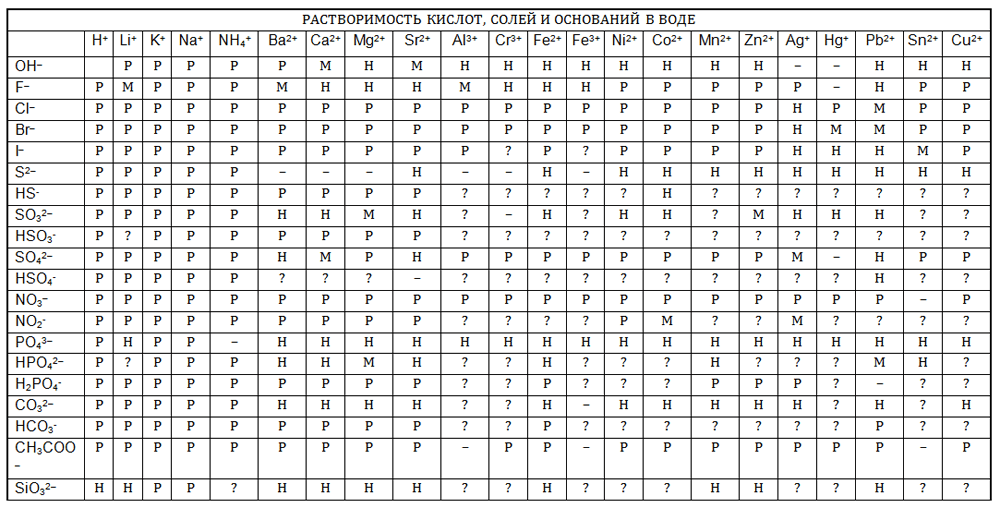
Ответ:
Хорошо растворимые: $AgNO_{3}$ – нитрат серебра (I), $BaCl_{2}$ – хлорид бария, $CaBr_{2}$ – бромид кальция, $MgI_{2}$ – иодид магния, $ZnSO_{4}$ – сульфат цинка, $Pb(NO_{3})_{2}$ – нитрат свинца (II).
Малорастворимые: $Ag_{2}SO_{3}$ – сульфит серебра (I), $BaF_{2}$ – фторид бария, $CaSO_{4}$ – сульфат кальция, $Mg(OH)_{2}$ – гидроксид магния, $ZnSO_{3}$ – сульфит цинка.
Практически нерастворимые: AgCl – хлорид серебра (I), $BaSO_{4}$ – сульфат бария, $CaCO_{3}$ – карбонат кальция, $Mg_{3}(PO_{4})_{2}$ – фосфат магния, ZnS – сульфид цинка, $PbI_{2}$ – иодид свинца (II).
3. Почему аквариумы нельзя заполнять быстро охлаждённой прокипячённой водой (она должна постоять несколько дней)?
Ответ:
Аквариумы нельзя заполнять быстро охлаждённой прокипячённой водой, так как при увеличении температуры растворимость газов уменьшается (кислорода в том числе), соответственно рыбам нечем будет дышать. Поэтому прежде чем заполнять прокипячённой водой аквариум, необходимо дать ей постоять, чтобы атмосферный кислород успел снова раствориться в ней.
4. Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
Ответ:
Серебро растворяется в воде с образованием ионов серебра, которые обладают бактерицидным действием, поэтому ранки промытые такой водой заживают быстрее.
5. Пользуясь рисунком 124, определите массовую долю хлорида калия, содержащегося в насыщенном растворе при 20°C.
Рис. 124. Растворимость веществ в зависимости от температуры.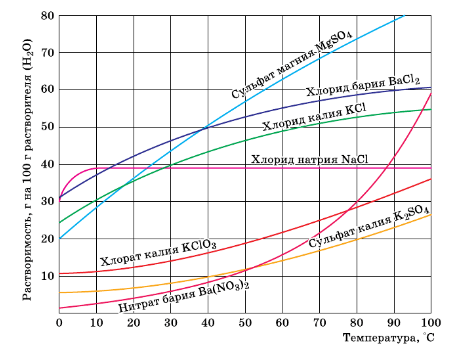
Ответ:
Дано:
m ($H_{2}O$) = 100 г;
__________________
ω (KCl) − ?
Решение:
Согласно рисунку при температуре 20°C в 100 г воды содержится 35 г KCl
m (р−ра) = m (вода) + m (KCl) = 100 + 35 = 135 г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω (KCl) =\frac{m (KCl)}{m (р-р)} = \frac {35}{135} = 0,26$ или 26%.
Ответ. 26 %.
6. Может ли разбавленный раствор быть одновременно и насыщенным?
Ответ:
Разбавленным называют раствор с низкой концентрацией вещества. Когда вещество малорастворимо, раствор может быть разбавленным и насыщенным одновременно.
7. К 500 г насыщенного при 20 °C раствора сульфата магния (см. рис. 124) прилили достаточный для проведения реакции объём раствора хлорида бария. Найдите массу выпавшего осадка.
Рис. 124. Растворимость веществ в зависимости от температуры.
Ответ:
Дано:
$m_{1} (H_{2}O)$ = 100 г;
$m_{2} (р-ра)$ = 500 г;
t = 20 °C;
_____________________
$ω (BaSO_{4})$ − ?
Решение:
$MgSO_{4} + BaCl_{2} = MgCl_{2} + BaSO_{4}↓$;
Согласно рисунку при температуре 20°C в 100 г воды содержится 37 г $MgSO_{4}$.
$m_{1}(р-ра) = m_{1} (H_{2}O) + m_{1}(MgSO_{4}) = 100 + 37 = 137$ г;
$ ω (вещ-во) =\frac{m (в-во)}{m (р-р)}$;
$ω (MgSO_{4}) =\frac{m_{1}(MgSO_{4})}{m_{1} (р-ра)} = \frac {37}{137} = 0,27$ или 27%;
m (вещ−во) = m (р−ра) * ω;
$m_{2}(MgSO_{4}) = m_{2} (р-ра) * ω = 500 * 0,27 = 135$ г;
$n = \frac{m}{M}$;
M ($MgSO_{4}$) = 1 * Ar (Mg) + 1 * Ar (S) + 4 * Ar (O) = 1 * 24 + 1 * 32 + 4 * 16 = 120 г/моль;
$n (MgSO_{4}) = \frac{m_{2}(MgSO_{4})}{M (MgSO_{4})} = \frac {135}{120} = 1,125$ моль;
Запишем уравнение реакции и составим пропорции:
$\underset{1 моль}{\overset{1,125 моль}{MgSO_{4}}} + BaCl_{2} = MgCl_{2} + \underset{1 моль}{\overset{x}{BaSO_{4}↓}}$;
$x = n (BaSO_{4}) = \frac{1,125 * 1}{1} = 1,125$ моль;
m = n * M;
M ($BaSO_{4}$)= 1 * Ar (Ba) + 1 * Ar (S) + 4 * Ar (O) = 1 * 137 + 1 * 32 + 4 * 16 = 233 г/моль;
$m (BaSO_{4}) = n (BaSO_{4}) * M (BaSO_{4}) = 1,125 * 233 = 262$ г.
Ответ. 262 г.

